Vor rund zehn Jahren ging der Name Emily Whitehead erstmals um die Welt. Das damals 7-jährige Mädchen war schwer an einer aggressiven Leukämie erkrankt. Alle verfügbaren Therapien hatten versagt. Die Ärzt:innen hatten das Mädchen schon fast aufgegeben, als sie sich zum Einsatz einer damals noch völlig neuen, experimentellen Behandlung entschlossen - einer CAR-T-Zelltherapie. Dabei wurden Zellen des körpereigenen Immunsystems der Patientin entnommen, außerhalb des Körpers modifiziert und danach wieder eingesetzt, um damit gezielt die Krebszellen anzugreifen. Die Leukämie bildete sich daraufhin zurück und das Mädchen ist seitdem krankheitsfrei.1 Heute führt Emily Whitehead ein Leben wie viele andere gleichaltrige Teenager und CAR-T-Zelltherapien sind als innovativer therapeutischer Ansatz bei bestimmten Formen von Blutkrebs verfügbar, wenn vorangegangene Behandlungen nicht mehr wirksam sind.
Mit innovativen Ansätzen der zunehmenden Therapieresistenz begegnen
Die Überlebensraten bei Blutkrebserkrankungen wie dem Multiplen Myelom oder bestimmten Formen aggressiver Lymphome haben sich in den letzten Jahren mithilfe eines breiten Therapiespektrums signifikant verbessert. Dennoch gibt es weiterhin einen erheblichen Bedarf nach neuen Behandlungsoptionen auf diesen Indikationsfeldern.2,3 Denn häufig kommt es nach initialer Behandlung zu einem Wiederauftreten der Erkrankung.4 So sprechen beispielsweise beim diffus großzelligen B-Zell-Lymphom (DLBLC) etwa zwei Drittel der behandelten Patient:innen auf eine zweite Therapie nicht an oder erleiden einen Krankheitsrückfall. Konventionelle Behandlungsoptionen, mit denen der krankheitsfreie Zustand dauerhaft aufrechterhalten werden kann, sind derzeit begrenzt und die Prognosen der Betroffenen in dieser Situation oftmals schlecht.5,6
„Wir arbeiten daran, für Menschen mit Blutkrebserkrankungen neue Perspektiven zu schaffen. Dabei rücken individualisierte Ansätze wie CAR-T-Zelltherapien, die das Immunsystem der Betroffenen im Kampf gegen den Krebs nutzen, zunehmend in den Fokus unserer Forschung. Unser Ziel ist es dabei, einer Chronifizierung bis hin zur potenziellen Heilung dieser schweren Krankheitsbilder immer näher zu kommen“, erklärt Dr. med. Ingo Abraham, Medizinischer Direktor Hämatologie bei Bristol Myers Squibb Deutschland.
CAR-T-Zelltherapie: Individuelle Einmal-Behandlung
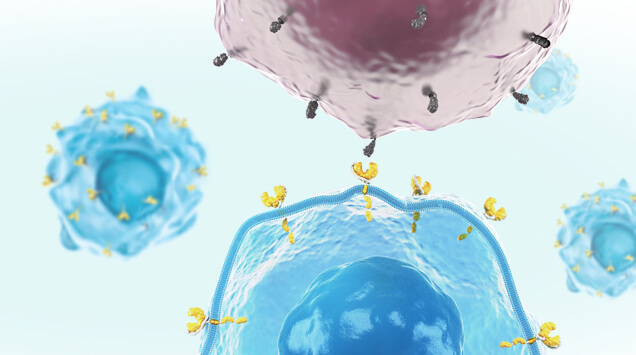
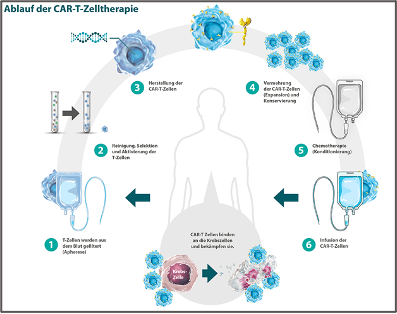
Doch wie funktioniert die CAR-T-Zelltherapie genau? Bei diesem Verfahren werden die T-Zellen des Immunsystems der Betroffenen außerhalb des Körpers modifiziert und mit einem bestimmten Protein ausgestattet, dem sogenannten chimären Antigenrezeptor (CAR). Dieser kann spezifische Strukturen (Antigene) auf der Oberfläche von Krebszellen erkennen. Nachdem Patient:innen die so angepassten T-Zellen in Form von CAR-T-Zellen per Infusion wieder zurück erhalten haben, können diese die Tumorzellen im Körper zielgerichtet identifizieren und daran binden (Schlüssel-Schloss-Prinzip). Einmal auf diese Weise aktiviert, leitet die CAR-T-Zelle die Zerstörung der Tumorzelle ein. Gleichzeitig vermehren sich die CAR-T-Zellen wie andere Zellen im Körper auch, sodass sie wie ein „lebendes Medikament“ im Körper verbleiben und jederzeit in der Lage sind, entsprechende Krebszellen anzugreifen.7,8